
중국 국가약품감독관리국(이하 NMPA)이 지난해 12월 26일자로 ‘화장품 신원료 허가·등록 자료 관리 규정’(개정안 의견조회안)에 대한 의견 조회를 오는 25일까지 요청한 것으로 확인했다. 중국 NMPA는 “화장품 감독관리 개혁을 한층 심화하고 화장품 원료 혁신을 지원하며 신원료 허가·등록 자료 요구사항을 최적화하기 위해 ‘화장품감독관리조례’ ‘화장품 허가·등록 관리 방법’ 등 법규 규정에 근거하고 산업 발전의 실제 상황을 종합 고려해 ‘화장품 신원료 허가·등록 자료 관리 규정’(개정안 의견조회안)을 공개, 의견을 조회한다”고 밝혔다. 의견 조회 기간은 오는 25일(일)까지다. 관련 의견과 건의사항은 의견 건의 회신표(부록 2)를 작성해 전자우편( hzpjgyc@nmpa.gov.cn )으로 접수하며 이메일 제목에는 ‘화장품 신원료 허가·등록 자료 관리 규정 의견 회신’이라는 문구를 명시해 달라고 요청했다. 개정을 추진하고 있는 ‘화장품 신원료 허가·등록 자료 관리 규정’은 모두 21조로 구성했으며 △ 적용 범위 △ 정보 서비스 플랫폼 사용 △ 사용자 정보 등록 △ 사용자 정보 갱신 △ 제출 자료 항목 △ 신원료 연구·개발 보고서 포함 내용 △ 제조 공정 △

중국국가약품감독관리국(이하 NMPA)이 지난 4일자로 ‘기 사용화장품 원료목록’을 조정, 흑삼추출물을 포함한 3종의 원료를 기 사용원료로 관리한다고 공고했다. 중국 NMPA는 “‘기 사용화장품 원료목록 관리 관련 사항에 관한 공고’에 따라 국가약품감독관리국은 기 사용화장품원료목록(이하 목록)에 대해 제 3차 조정을 실시했다”고 밝혔다. 이에 따라 목록Ⅰ의 업데이트·조정 내용은 두 가지로 요약할 수 있다. 첫째, 기존에 화장품 신원료 허가·등록이 취소됐던 △ 흑삼추출물 △ 가수분해히알루론산아연 △ 갈락토만난 등 3종 원료에 대해 심사를 거쳐 ‘목록Ⅰ’에 포함시키고 해당 원료의 비고란에 이를 명확했다. 둘째, 관련 원료의 중문명칭 또는 INCI 명칭·영문 명칭을 표준화하고 비고 사항 등을 수정했다. <‘기 사용화장품 원료목록 조정 설명’(2026년 1월 4일자)에 대한 내용은 아래 첨부문서 또는 https://www.nmpa.gov.cn/hzhp/hzhpjgdt/20260104142237112.html 참조>

중국 국가식품약품감독관리국(이하 NMPA)이 화장품 원료 혁신 지원에 관한 9개 항목의 규정을 지난 6일자로 공포하고 즉각 시행에 들어간다고 밝혔다. 중국 NMPA는 “중국공산당 제 20기 중앙위원회 제 3차 전체회의 정신을 철저히 이행하고 화장품 원료의 혁신을 더욱 장려하며 화장품 산업의 고품질 발전을 촉진하기 위해 ‘화장품 감독관리조례’ 등 관련 법규의 요구에 따라 국가약품감독관리국은 ‘화장품 원료의 혁신을 지원하기 위한 규정’을 제정, 공포하고 시행한다”고 공고했다. 화장품 원료 혁신 지원에 관한 규정 이와 함께 중국 NMPA는 “개혁을 심화하며 화장품 혁신 발전 메커니즘을 정비하고 화장품 원료 혁신을 장려하는 것을 중점으로 하며 시장 수요를 기반으로 한 화장품 원료 협력 혁신 체계를 구축하는 것을 목표로 본 규정을 제정한다”고 해당 규정의 제정 의미를 부여하고 있다. 1. 신원료 허가·등록 분류 기술 요구사항 최적화 화장품 신원료 허가·등록 분류 관리와 기술 평가 체계를 개선한다. 즉 원료의 특성·기능·기대 용도·혁신 특징에 따라 기술 요구사항을 최적화하고 기업이 신원료를 판단하고 분류 연구를 진행할 수 있도록 기술 지침을 강화하겠다는 것. 국내·외에

중국 국가약품감독관리국(이하 NMPA)이 ‘화장품 안전성 평가 관리 최적화를 위한 여러 조치를 발표하는 것에 관한 공고’(2024년 제50호) 발표를 통해 지난 5월 1일 시행을 앞두고 있던 중국 화장품 안전성 평가보고서 전체 버전 제출을 내년으로 연기한다는 방침을 확정한 바 있다. 중국 당국의 이같은 결정으로 지난 2021년 5월부터 제출해 오던 안전성 평가 보고서 간소화 버전은 현 상황 그대로 내년 4월 말까지 제출이 가능해졌다. <코스모닝닷컴 2024년 4월 23일자 기사 ‘中 NMPA, 화장품 안전성 평가 전체 버전 제출 1년 유예’ https://cosmorning.com/news/article.html?no=47888 참조> 관련해 최근 중국식품약품검정연구원(이하 NIFDC)이 ‘화장품 안전성 평가 자료 제출 지침'에 관한 질의응답 가이드를 발표하고 이에 대한 이해를 돕고 있다. 중국 NIFDC는 해당 질의응답 가이드에서 △ 화장품 안전성 평가 자료 제출 지침 제정 배경 △ 주요 내용 △ 자체검사 시행 이유 △ 안전성 평가 보고서 보관 이유 △ 화장품 완제품에 대한 안전성 테스트의 적용 원칙 등에 대해 해설을 통해 관련 업계의 대응 방안

글로벌 차원의 화장품 안전성 평가에 대한 중요성이 커지고 이에 따른 규제 강화 움직임이 대세로 자리잡고 있는 가운데 한국과 중국의 해당 부문 상호 교류가 보다 활발하게 이뤄질 전망이다. (재)대한화장품산업연구원(원장 이재란· www.kcii.re.kr ·이하 연구원)과 중국 국가약품감독관리국(이하 NMPA)은 지난 16일 ‘한-중 화장품 안전성 평가 연구 상호교류’ 회의를 열고 양 국 간의 현 상황에 대한 인식의 폭을 넓히는 동시에 관련 부문에 대한 정보를 교류했다. 이번 회의에는 △ 연구원·식약처 화장품정책과·대한화장품협회(한국) △ 중국 NMPA·화장품감독관리사(중국) 등 두 나라의 화장품 안전성 평가연구 관련 정부 관계자와 전문가들이 참석했다. 연구원과 NMPA는 각 기관에서 수행하는 화장품 성분 안전성 평가 현황을 소개하고 현재 이슈 사항라고 할 천연성분 안전성 평가 연구 방법에 대한 논의에 집중했다. 특히 지난 4월 30일로 예정했던 중국 화장품감독관리조례 유예기간을 내년 4월 30일(2025년 5월 1일부터 전체 버전 제출)로 연기한 데 따른 후속 조치로 화장품에 사용하는 모든 성분에 대한 안전성 평가 보고서 전체 버전 제출 등 중국 정부의 관련

오는 5월 1일 시행을 앞두고 있던 중국 화장품 안전성 평가보고서 전체 버전 제출이 1년 뒤로 전격 연기됐다. 중국 국가약품감독관리국(이하 NMPA)은 지난 22일자로 ‘화장품 안전성 평가 관리 최적화에 관한 고시’(2024년 제50호)를 발표했다. NMPA는 공고문을 통해 “화장품 연구 개발에 기업 연구개발 자원의 반복적인 투자를 피하기 위해 일정 기간이 필요하다는 사실을 고려, 오는 2025년 5월 1일 이전까지 화장품 등록자나 출원인이 화장품 등록 신청 또는 안전성 평가 보고서 제출 시 가이드 라인의 요구사항을 충족하는 간소화 버전의 화장품 안전성 평가 보고서를 제출할 수 있도록 유예기간을 연장한다”고 1년 유예를 공식 선언했다. 중국 당국의 이같은 결정으로 지난 2021년 5월부터 제출해 오던 안전성 평가 보고서 간소화 버전을 현 상황 그대로 내년 4월 말까지 제출이 가능해졌다. 안전성 평가 보고서 간소화 버전 유지 이외에도 NMPA는 “화장품 안전성 평가 데이터를 분류해 관리하고 일부 자격을 갖춘 일반 화장품은 기본 안전성 평가 결론을 제출하도록 허용하며 안전성 평가 보고서는 향후 참고를 위해 각 기업이 보관해야 한다”는 사실도 확인했다. NMP

지난해 12월 한 달 동안 중국국가약품감독관리국(이하 NMPA)이 화장품 신원료(NCI)로 추가 승인한 품목은 모두 13개에 이르는 것으로 나타났다. 리이치24시코리아가 리이치24H컨설팅그룹의 켐링크드를 통해 제공하고 있는 국제 화장품 규제 업데이트에 따르면 중국 NMPA는 2023년 12월 한 달 동안에만 화장품 신원료로 13개에 대한 고시 내용을 밝히고 이에 대한 추가 사항을 고지했다. 리이치24시코리아는 이와 관련해 “새롭게 승인한 이들 13개 성분의 경우 상세한 기술 정보를 공개하지 않은 상태이기 때문에 현재까지 파악해 공개한 명칭은 중(한)문 명칭을 기준으로 한 영문 표기이며 해당 기업에서 제공하는 INCI 명칭과 다를 수 있다는 점을 고려해야 한다”고 밝혔다. 중국 NMPA가 추가로 승인한 13개의 신원료는 △ Pyrroloquinoline quinone disodium(PQQ) salt(CAS No. 122628-50-6: 12월 4일) △ α-Dextran Hydroxypropyltrimonium Chloride(12월 7일) △ Candida Bombicola/Glucose/Prinsepia Utilis Oil Ferment(12월 11일)

중국 정부의 신원료 관련 혁신성 강화와 관리 표준화를 위한 정비 작업이 본격화할 전망이다. 중국 국가식품약품감독관리국(이하 NMPA)이 지난 11월에 ‘화장품 신원료 혁신 장려와 관리 표준화에 관한 공지’(關於化妝品新原料鼓勵創新和規範管理有關事宜的公告·이하 공지)를 통해 화장품 신원료 등록·사용·감독에 이르기까지 전체 관리감독 프로세스를 정비할 방침을 밝혔기 때문. 이번 공지의 내용의 핵심은 크게 3가지로 요약할 수 있다. 즉 △ 기술지도 서비스 강화·신원료의 연구개발 장려 △ 원료·제품의 품질 안전 보장을 위한 기업 책임 강화 △ 관리감독 체계 개선을 통한 화장품 산업 전반의 건전한 발전 추구 등이다. 기존 ‘등록·비안’ 규정 준수의 중요성 신원료 등록자(註冊人)와 비안자(備案人)는 원료의 출처·기(성)능·사용 목적·제조 공정·품질 관리를 포함해 기타 관련 안전성에 대한 과학성 기반의 연구를 수행하고 화장품 원료의 사용 목적·적용 범위·안전한 사용량에 대한 충분한 검증을 요구하고 있다. 원료의 사용 목적과 안전한 사용량 등을 조정할 때 역시 필요에 따라 등록 또는 비안을 해야 한다. 여기서 의미하는 ‘비안’은 통상 승인이 끝난 사항에 대해 사후 점검 또는 증

중국 국가약품감독관리국(이하 NMPA)이 지난 9월 4일을 기점으로 산하 기관 중국식약품검정연구원(이하 NIFDC)를 통해 기사용 화장품 원료 안전성 정보 등록 플랫폼(이하 플랫폼) 업데이트를 시행하고 ‘단일 조성 원료만 등록 가능’하도록 변경했던 방침을 철회했다. 해당 정책의 시행 당시에도 여러 측면에서 논란이 예상됐지만 시행 2개월이 채 되지 않은 시점에서 다시 이전의 운영방침으로 복귀했다는 점에서 이례적이라는 업계의 반응이다. <코스모닝닷컴 10월 3일자 기사 ‘中 화장품 원료 등록 플랫폼 운영 규정 강화’ 참조 https://cosmorning.com/news/article.html?no=46524 > 글로벌 화장품 규제대응 컨설팅 기업 리이치24시코리아(주) 측은 “플랫폼 운영방침이 이번 재개정을 통해 지난 9월 이전으로 변경한 사실을 확인했다”고 밝히고 “이에 따라 이전과 같이 ‘복합원료’를 등록할 수 있는 상태로 바뀌었다”고 전했다. 이 회사 중국 업무 담당자는 이와 관련해 “지난 9월 개정 때와 마찬가지로 이번에도 관련 당국의 별도 공지가 이루어지지 않았다. 현재 중국 NMPA 내부에서도 심한 혼란을 겪고 있는 것으로 파악하고 있다”
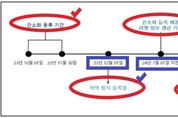
중국 정부가 화장품과는 별도로 치약에 대한 별도 규정을 마련, 시행에 들어간다. 중국 국가약품감독관리국(이하 NMPA)은 지난달 25일자로 ‘치약 감독관리조치’ 규범에 따라 치약 규제 요구사항과 현재 시판 중인 치약 등록 요건 간소화에 관한 사항을 발표했다. 이는 지난 3월 23일 중국 국가시장관리감독총국(이하 SAMR)이 발표한 ‘치약감독관리방법’에 대해 구체화한 제품 등록에 관한 내용을 담고 있다. 이에 따라 중국 시장에 판매할 치약 제품은 오는 12월 1일부터 ‘치약등록 정보서비스 플랫폼’을 통해 등록 진행을 필수화하고 간소화 등록 요건 등의 내용을 숙지해야 할 필요가 생겼다. 해당 규정의 주요 내용은 △ 중국으로 수출하는 치약 제품들은 올해 12월 1일부터 제품 출시 이전에 치약등록 정보서비스 플랫폼을 통해 등록을 반드시 진행해야 하고 △ 제품 등록 시 제품 효능에 대한 근거자료 개요도 함께 제출이 요구하되 ‘청결’ 효능만 클레임하는 제품은 효능 근거자료 개요 제출을 면제한다는 것 등이다. 해당 플랫폼은 지난달 22일부터 가동하기 시작했다. 이와 함께 12세 이하의 어린이가 사용하는 어린이 치약에 관한 내용도 포함하고 있다. 즉 어린이용 치약은 ‘청결

중국 정부의 화장품 원료 안전 정보 등록 규정이 한층 강화돼 시행에 들어갔다. 이에 따라 중국 화장품 원료 등록과 관련한 우리나라 기업의 대응 역시 또 다른 장벽을 뚫어야 할 상황에 놓일 가능성이 높아지고 있다. 관련 업계에 따르면 중국 국가약품감독관리국(이하 NMPA)은 산하 기관 식약품검정연구원(이하 NIFDC)을 통해 화장품 원료 안전 정보 등록 플랫폼 운영 방침을 개정했으며 특히 원료 안전 정보 등록의 경우 기존 ‘단일·복합 조성 원료 모두 등록 가능’에서 ‘단일 조성 원료만 등록 가능’으로 변경하는 등 국내 기업의 대응이 한층 까다로워질 가능성이 짙어지고 있다는 것. 등록 플랫폼의 주요 업데이트 내용을 살펴보면 우선 중국 화장품 기 사용 원료 목록에 명기한 순번을 입력할 수 있도록 추가했다. 이에 따라 등록 하고자 하는 원료의 기 사용 목록의 순번을 입력하면 자동으로 해당 하는 성분명에 대한 조회가 가능하다. 두 번째는 단일 조성 원료만 등록이 가능하도록 시스템을 변경했다. 이에 더해 기존 복합원료 조성비 입력란 역시 두 개 이상의 성분을 입력할 수 없도록 변경함으로써 복합 원료의 안전 정보 등록이 불가능해졌다. 이전까지 복합 원료를 등록하면서 기재

우리나라 화장품 제조판매증명서를 전자서명한 양식으로 발급하는 절차가 개선될 전망이다. 동시에 지금까지 직접 날인한 제조판매증명서 만을 인정했던 중국의 경우에도 전자서명 제조판매증명서을 인정할 가능성도 높아졌다. 대한화장품협회(회장 서경배· www.kcia.or.kr )는 오늘(31일) 홈페이지 공지를 통해 “지금까지 화장품 제조판매증명서를 화장품협회에서 직접 날인해 발급해 왔으나 앞으로 화장품 기업의 업무 편의성과 문서 신뢰도를 높이기 위한 차원에서 전자서명한 증명서 양식으로 변경, 발급할 예정”이라고 공식화했다. 화장품협회 측은 이와 함께 “앞으로 기업이 제조판매증명서를 신청하고 협회에서 확인 절차 후 제조판매증명서 발급을 승인하면 전자서명 증명서를 신청업체가 직접 출력해 사용할 수 있도록 프로세스를 한 단계 더 개선할 예정”이라고 밝히고 “다만 발급 완료한 전자서명 증명서를 신청업체가 직접 출력할 경우 출력 지원이 가능한 프린터인지 먼저 확인이 필요하며 이는 관련 매뉴얼을 통해 확인 가능하다”고 덧붙였다. 그럼에도 불구하고 신청업체가 직접 증명서 출력을 할 수 없는 경우에는 신청업체 요청시 화장품협회가 출력해 발송하는 과정을 거칠 예정이다. 관련해 화장품